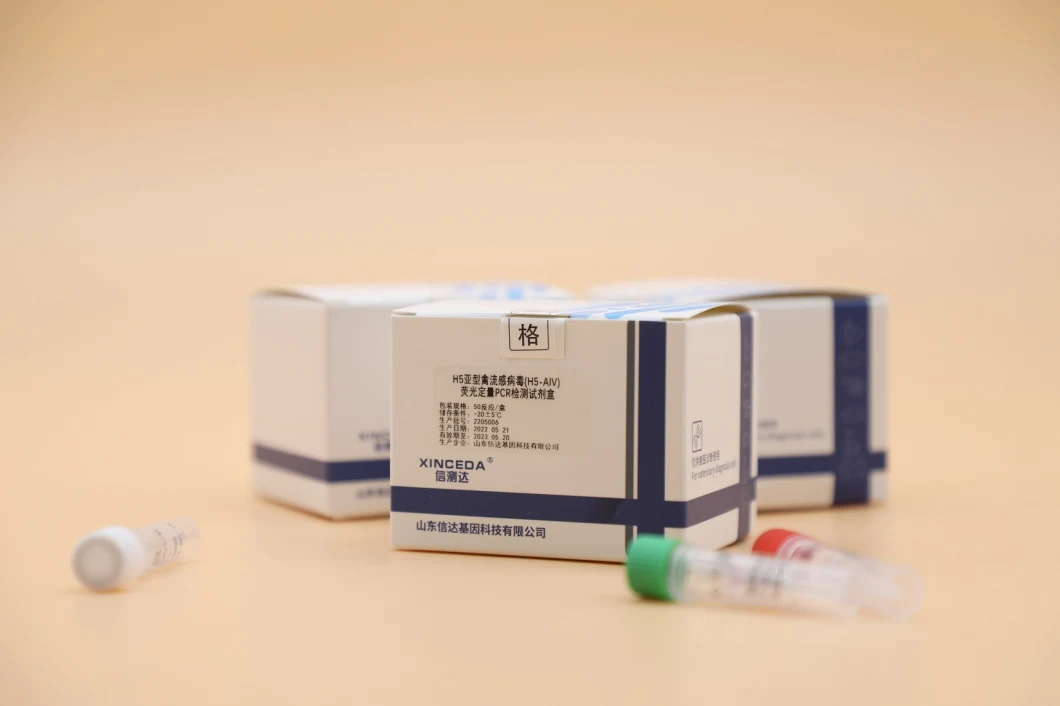
Nachweiskit für das Aviäre Influenzavirus H5/H7/H9/Universal-Subtyp Rna (PCR-Fluoreszenzsondierung)
Basisinformation
| Modell Nr. | H5/H7/H9/Universal-PCR |
| Typ | Erkennungskit |
| Spritze | N / A |
| Blutentnahmenadel | Kunststoffrohr |
| Atemmuster | N / A |
| Methode zur Steuerung von Tieranästhesiegeräten | N / A |
| Haltbarkeit | 12 Monate |
| Temperatur | -20 |
| Einfrieren und Auftauen | Weniger als dreimal |
| Anwendbar | Alle PCR-Instrumente |
| GMP | 15074 |
| Transportpaket | Luftweg/Seeweg |
| Spezifikation | 50 KITS/BOX |
| Warenzeichen | ASCHE |
| Herkunft | China |
| HS-Code | 3822001010 |
| Produktionskapazität | 50000 Karton/Jahr |
Produktbeschreibung
Nachweiskit für das Aviäre Influenzavirus H5/H7/H9/Universal-Subtyp-RNA (PCR-Fluoreszenzsondierung)(Produktname) Nachweiskit für das Aviäre Influenzavirus H5/H7/H9/Universal-Subtyp-RNA (PCR-Fluoreszenzsondierung)
(Paket) 50 Kits/Karton
(Indikation) Das Nachweiskit für das Aviäre Influenzavirus H5/H7/H9/Universal-RNA (PCR-Fluoreszenzprüfung) eignet sich zum Nachweis des Aviären Influenzavirus H5/H7/H9/Universal-RNA in Vogel-Rachenabstrichen, Kloakenabstrichen, Gewebe, Allantoisflüssigkeit des Hühnerembryos und Zellkultur. Die Testergebnisse dienen ausschließlich Forschungszwecken und nicht der klinischen Diagnose.
(Hauptbestandteile und Inhalte)
| Name | Spezifikation | Menge |
| H5/H7/H9/Universelle dreiwertige Reaktionslösung | 1250 µl/Röhrchen | 1 |
| H5/H7/H9/Universal-Positivkontrolle | 250 µl/Röhrchen | 1 |
| Negativkontrolle | 250 µl/Röhrchen | 1 |
Bei Lagerung bei -20 ± 5 °C und wiederholtem Einfrieren und Auftauen ≤ 3 Mal beträgt die Haltbarkeit 12 Monate.
(Modell)
ABI 7500, ABI QuantStudio 5, CFX Connect, CFX Opus 96, LightCycler480, Gentiter 96E/96R, LineGene 9600 Plus und andere fluoreszierende quantitative PCR-Verstärker.
(Testmethode)
- Nukleinsäureextraktion
- PCR-Amplifikation
2.2 Geben Sie jeweils 5 µl Nukleinsäure der Negativkontrolle, der Positivkontrolle und der Proben in die oben genannten PRC-Reaktionsröhrchen, zentrifugieren Sie sie einige Sekunden lang bei 8000 U/min und geben Sie sie in den fluoreszierenden quantitativen PCR-Verstärker.
2.3 Die Reaktionsbedingungen werden wie folgt eingestellt:
| Relevante Parameter des Verstärkers | |||
| System | Gesamtvolumen: 30 µl | ||
| Signalsammlung | Vogelgrippe H5/H7/H9/Universal | H5-Subtyp – HEX-Kanal sammelt Fluoreszenzsignale | |
| H7-Subtyp – FAM-Kanal sammelt Fluoreszenzsignal | |||
| H9-Subtyp – Cy5-Kanal sammelt Fluoreszenzsignal | |||
| Universell – ROX-Kanal sammelt Fluoreszenzsignal | |||
PCR-Reaktionsbedingungen | Bühne | Zustand | Zyklusnummer |
| Reverse Transkription | 55 °C: 15 Minuten | 1 | |
| Vordegeneration | 95 °C: 30 Sekunden | 1 | |
PCR | 95 °C: 10 Sekunden | 40 | |
| 56 °C: 30 Sekunden (Eingestellt, um das Fluoreszenzsignal am Ende dieser Phase zu sammeln) | |||
(Interpretation der Ergebnisse)
- Bestimmung der Wirksamkeit des Testkits:
- Schwache Positivkontrolle: Ct-Wert der FAM-, HEX-, Cy5- und ROX-Kanäle ≤ 32, Amplifikationskurve mit offensichtlicher exponentieller Phase.
- Blindkontrolle: FAM-, HEX-, Cy5- und ROX-Kanäle haben keine Verstärkungskurve oder die Verstärkungskurve ist gerade oder leicht schräg, keine signifikante exponentielle Phase und ein Ct-Wert ≥ 38 oder kein Ct-Wert.
- Ermittlung der Ergebnisse:
| Ergebnisurteil | FAM-Kanal | HEX-Kanal | Cy5-Kanal | ROX-Kanal |
| Nukleinsäure positiv für den Aviären Influenzavirus H5-Subtyp | - | + | - | + |
| Nukleinsäure positiv für den Aviären Influenzavirus H7-Subtyp | + | - | - | + |
| Nukleinsäure positiv für den Aviären Influenzavirus H9-Subtyp | - | - | + | + |
| Aviärer Influenzavirus H5/H7-Nukleinsäuresubtyp positiv | + | + | - | + |
| Aviärer Influenzavirus H5/H9-Nukleinsäuresubtyp positiv | - | + | + | + |
| Aviärer Influenzavirus H7/H9-Nukleinsäuresubtyp positiv | + | - | + | + |
| Aviärer Influenzavirus H5/H7/H9-Nukleinsäure-Subtyp positiv | + | + | + | + |
| Nukleinsäure positiv für gering pathogenes Aviäres Influenzavirus | - | - | - | + |
| Nukleinsäure negativ für das Aviäre Influenzavirus | - | - | - | - |
- Wenn eine logarithmische Wachstumsphasen-Amplifikationskurve vorliegt und der Ct-Wert ≤ 36 ist, wird er als + beurteilt. Wenn keine Verstärkungskurve vorhanden ist oder der Ct-Wert > 36 ist, wird dies als - beurteilt. Die Proben sind verdächtig, wenn 36 < Ct-Wert <40 ist, was erneut getestet werden muss.
- Wenn die Ergebnisse eines H5/H7/H9-Subtyps + mit ROX-Kanal - sind, muss dies erneut getestet werden.
- Das Labormanagement muss in strikter Übereinstimmung mit den Managementspezifikationen des PCR-Genamplifikationslabors erfolgen. Das Laborpersonal muss fachlich geschult sein. Der Versuchsprozess muss ausschließlich in verschiedenen Bereichen durchgeführt werden (Bereich für die Reagenzienvorbereitung, Bereich für die Probenvorbereitung, Bereich für Amplifikation und Produktanalyse). Alle Verbrauchsmaterialien müssen nach der Sterilisation wegwerfbar sein. Spezielle Geräte, Ausrüstungen und Hilfsmittel dürfen in jeder Phase des Versuchsbetriebs nicht kreuzweise verwendet werden.
- Bitte bereiten Sie die biologische Sicherheitswerkbank für die Reagenzien- und Probenvorbereitungsphase vor. Der Laborkittel, die Einweghandschuhe und die Pipette sind während des Experiments mitzuführen.
- Wiederholtes Einfrieren und Auftauen von Reagenzien ist möglichst zu vermeiden. Vor der Verwendung müssen die Reagenzien vollständig aufgetaut und einige Sekunden lang bei 8000 U/min zentrifugiert werden.
- Bitte legen Sie die im Probenvorbereitungsbereich verwendete Pipette in den Behälter mit dem Desinfektionsmittel und entsorgen Sie sie nach der Sterilisation mit dem Abfall.
- Nach dem Experiment wurden der Arbeitstisch und die Pipette mit 10 % Hypochlorit oder 75 % Alkohol oder einer UV-Lampe behandelt.
(Herstellung)
Name: Shandong Xinda Gentechnologie
Eine Tochtergesellschaft der Shandong Sinder Technology
Adresse: Gebäude B2, Bandaohuigu Industrial Park, Shungeng Road, Stadt Zhucheng, Provinz Shandong
Shandong Sinder Technology („Sinder“) wurde im April 1999 gegründet und verfügt über ein breites Sortiment an Tiergesundheitsprodukten. Sinder konzentriert sich auf Tiergesundheitsprodukte, Tierimpfstoffe, Antikörper, Antibiotika, Futtermittelzusatzstoffe, chinesische Kräuterprodukte, Tiernahrung, Elisa und PCR-Testkits.
Sinder hält stets am Kernkonzept des „unermüdlichen Strebens nach der Steigerung des Kundenwerts“ fest. „Ausgehend von der Tiergesundheit entsteht ein Dienstleister für den ökologischen Aufbau der Landwirtschaft und Tierhaltung.“ Unterstützen Sie die effiziente und nachhaltige Entwicklung der Landwirtschaft und Tierhaltung. Machen Sie Lebensmittel sicherer und ländliche Gebiete besser!
Sinder ist ein High-Tech-Unternehmen und einer der zehn größten Hersteller von Tierarzneimitteln in China mit Schwerpunkt auf dem Tiergesundheitsgeschäft. Derzeit verfügt das Unternehmen über 35 GMP-Produktionslinien, 1 CNAS-Labor, 3 nationale wissenschaftliche Forschungsplattformen und 8 provinzielle wissenschaftliche Forschungsplattformen im Besitz von Sinder.
Sinder verfügt über vier Forschungs- und Entwicklungszentren in Qingdao, Zhucheng und Peking (China) sowie ein Labor im Silicon Valley in den USA. Derzeit beschäftigt das Unternehmen 1.535 Mitarbeiter, darunter mehr als 200 Meister und 18 Ärzte. Darüber hinaus hat das Unternehmen eine umfassende technische Zusammenarbeit mit mehreren in- und ausländischen wissenschaftlichen Forschungsinstituten, Tiergesundheitsunternehmen und inländischen Veterinärmedizinunternehmen aufgebaut. Sinder hat 57 nationale, provinzielle und ministerielle Projekte durchgeführt, 7 provinzielle und ministerielle Auszeichnungen für wissenschaftlichen und technologischen Fortschritt gewonnen, 23 nationale Standards geleitet oder daran teilgenommen, 23 neue Zertifikate für Tierarzneimittel (ein neues Medikament erster Klasse) erhalten und 60 Patente genehmigt .